En la clase de Química de tercero de secundaria, se verá el tema: “¿Cómo es el sistema de clasificación de los elementos químicos?”, a través del cual reconocerás la organización de los elementos químicos en grupos y periodos, así como su carácter metálico.
La Tabla Periódica de los Elementos
La tabla periódica es una herramienta irremplazable en la enseñanza de la Ciencia. Química.
Para comprender cómo es el sistema de clasificación de los elementos químicos, retomarás las aportaciones de Mendeléiev y Moseley, el modelo atómico de Bohr y la estructura de Lewis.
En la construcción de los modelos atómicos de los primeros dieciocho elementos químicos, te basarás en su estructura a partir del modelo atómico de Bohr.
Para comprender los criterios de clasificación de los elementos químicos, tomarás en cuenta el número atómico, los electrones de valencia y el número de órbitas o niveles energéticos.
Con ellos analizarás la organización de la tabla periódica en grupos y periodos.
Finalmente, de acuerdo con la posición que ocupen los elementos químicos en la tabla periódica, identificarás la tendencia de su carácter metálico.
Es de suma importancia que registres y respondas las preguntas, también que lleves a cabo las actividades que se plantean durante la sesión, para que los conocimientos y las habilidades desarrolladas las apliques en la construcción de modelos atómicos tridimensionales de los elementos químicos.
¿Sabías que en 1844 Charles Goodyear patentó un proceso conocido como vulcanización en el que el elemento clave del proceso fue el azufre?
¿Qué es la tabla periódica de los elementos químicos?
Es el sistema de clasificación de los elementos químicos de acuerdo al número atómico, en periodos y grupos.
¿Qué se entiende por sistema de clasificación?
Es el agrupamiento de los elementos de acuerdo con sus propiedades o atributos comunes entre ellos.
¿Cómo están organizados los elementos químicos en la tabla periódica?
En orden ascendente del número atómico, de izquierda a derecha. Inicia con el hidrógeno en la parte superior.
Observa la tabla periódica. ¿Cuántas filas tiene?
Son 7 filas horizontales, llamados periodos, hasta completar los 118 elementos químicos conocidos.
¿Cuántas columnas tiene?
Los elementos químicos están acomodados en 18 columnas verticales llamadas grupos. Este sistema de clasificación ordenó los elementos químicos con base en sus propiedades físicas y químicas; cabe señalar que ha tenido pocas variaciones en casi 150 años de haber sido propuesta.
¿A qué se le llama periodo en la tabla periódica?
Observa la tabla periódica. A los renglones horizontales de la tabla periódica se les denomina periodos y se numeran del 1 al 7.
En un mismo periodo se va incrementando uno a uno el número de protones, de acuerdo con su número atómico.
El número de periodo está relacionado con el número de órbitas en las que están distribuidos los electrones en los átomos de los elementos químicos.
El número máximo de electrones de valencia en cada órbita son: 2 en la primera, 8 en la segunda y 18 en la tercera.
¿A qué se le llama grupo en la tabla periódica?
Observa nuevamente tu tabla periódica. Los grupos se numeran de izquierda a derecha y son 18 grupos.
En esta sesión te centrarás en los elementos químicos representativos, es decir, en los grupos 1, 2, 13, 14, 15, 16, 17 y 18 de la tabla periódica.
Recuerda que, de acuerdo con la estructura de Lewis, los electrones de valencia que tienen los átomos de los elementos de cada grupo son:
-
Para el grupo uno, un electrón de valencia.
-
Para el grupo dos, dos electrones de valencia.
-
Para el grupo trece, tres electrones de valencia.
-
Para el grupo catorce, cuatro electrones de valencia.
-
Cinco electrones de valencia para el grupo quince.
-
Seis electrones de valencia para el grupo dieciséis.
-
Siete para el grupo diecisiete.
-
Y ocho para el grupo dieciocho.
Una manera de identificar fácilmente los electrones de valencia en cada grupo es considerar el número con el que termina, por ejemplo, el grupo 13 tiene 3 electrones de valencia; el grupo 14, 4 electrones de valencia, y así sucesivamente.
Ahora construye el modelo atómico del litio, Li. Éste tiene el número atómico 3 en la tabla periódica, ¿podrías deducir cuántos protones tiene? Y, por lo tanto, ¿cuántos electrones? Tres.
¿Qué es el carácter metálico?
Una de las propiedades más importantes que encuentras al consultar la tabla periódica es el carácter metálico. Éste se refiere a la tendencia de los elementos químicos para alcanzar la estructura del gas noble más cercano. A un elemento químico se le considera metal cuando tiende a perder electrones de valencia y forma cationes.
Los metales ocupan más de tres cuartas partes de los elementos en la tabla periódica. Algunas de sus propiedades físicas: tienen un brillo característico, son dúctiles y maleables, buenos conductores del calor y la electricidad. Sus puntos de fusión y ebullición son altos. Tienen alta densidad. La mayoría son duros: no se rayan con facilidad. Son tenaces: resisten los golpes y las altas presiones. Son sólidos a temperatura ambiente, excepto el mercurio, el galio, el cesio.
En cambio, al elemento químico que tiende a ganar electrones, para alcanzar la estructura más estable del gas noble más cercano, se le conoce como no metal y tiende a formar aniones.
¿Qué caracteriza a los elementos metálicos?
Algunas propiedades físicas de los no metales es que son opacos, excepto el yodo, que es brilloso; frágiles, excepto el carbono en su forma de diamante; malos conductores del calor y la corriente eléctrica, excepto el carbono en forma de grafito. No son dúctiles ni maleables. En general, tienen baja densidad. Los hay sólidos, líquidos y gases.
Los metaloides, por estar en el límite entre los metales y los no metales, presentan propiedades semejantes a ambos, según el elemento con el cual forman un enlace químico.
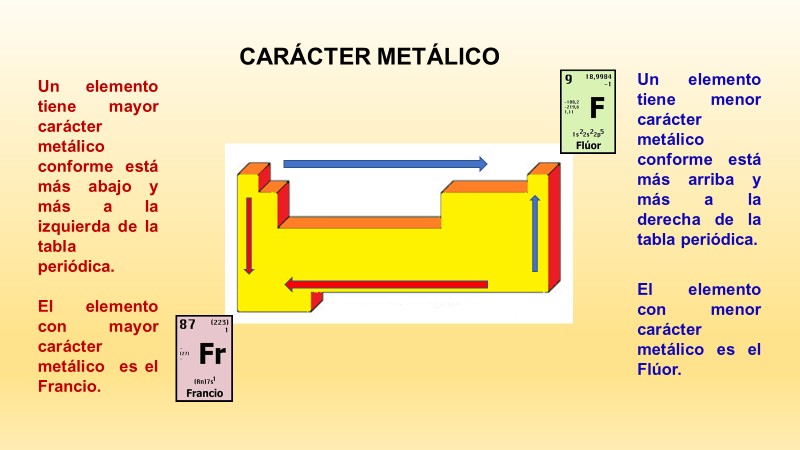
¿En qué dirección aumenta el carácter metálico de los elementos químicos en la tabla periódica?
El carácter metálico aumenta al moverte de derecha a izquierda y de arriba hacia abajo en la tabla periódica.
Observa la siguiente imagen:

Al realizar este ejercicio, puedes observar que el elemento más metálico es el francio.
Ahora, si te mueves en el sentido contrario, encontrarás que el elemento menos metálico es el flúor.
El hidrógeno es la excepción, ya que se localiza en el extremo izquierdo de la tabla debido a su estructura atómica; no obstante, comparte propiedades químicas con el grupo de los halógenos, por lo que es considerado un no metal.
Aunque la mayoría de los elementos conocidos son metálicos, la abundancia de cada uno de ellos en la Tierra como en otras regiones del Universo, es pequeña comparada con la de elementos no metálicos como el hidrógeno, el helio y el oxígeno.
Cerca de 91% de todos los átomos del Universo son de hidrógeno, 8.75% son átomos de helio y sólo 0.25% restante son átomos de otros elementos.
Además de haber construido sus modelos atómicos, lograste ubicarlos en la tabla periódica.
Debes reconocer que los elementos químicos están ordenados en la tabla periódica en orden creciente de su número atómico.
Recuerda que el grupo al cual pertenecen los elementos químicos está relacionado con el número de electrones de valencia, y que el número de periodo corresponde al número de órbitas que tienen los átomos de los elementos químicos.
Así como también tener presente que los elementos metálicos tienen la tendencia de ceder electrones de valencia y formar cationes. Los elementos que pertenecen a los no metales tienden a aceptar electrones y formar aniones. La importancia de conocer las propiedades de los elementos químicos en la vida cotidiana se debe a que éstos contribuyen al desarrollo del cuerpo humano. Sabes que el elemento azufre, un no metal de color amarillo capaz de fundirse y cambiar al color naranja rojizo, no podría ser ingerido de esta forma.
Sin embargo, sí puede ser ingerido en alimentos que lo contienen, como el ajo y el pescado; contribuye a formar proteínas en el organismo.
TAMBIÉN TE PUEDE INTERESAR: